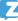Thu hồi toàn quốc thuốc dung dịch uống Batiwell
Lô thuốc dung dịch uống Batiwell (Bromhexin hydroclorid 0,8mg/ml) do Công ty cổ phần 23 tháng 9 sản xuất đã bị buộc phải thu hồi toàn bộ.
Cục Quản lý Dược (Bộ Y tế) vừa ra thông báo buộc phải thu hồi toàn quốc lô thuốc dung dịch uống Batiwell (Bromhexinhydroclorid 0,8mg/ml), Số GĐKLH: VD-31011-18, Số kiểm soát: 00121, NSX:08/03/2021, HD: 08/03/2024 do Công ty cổ phần 23 tháng 9 sản xuất, chỉ định để hỗ trợ điều trị nhiễm khuẩn đường hô hấp cấp hoặc mạn tính có ho xuất tiết.
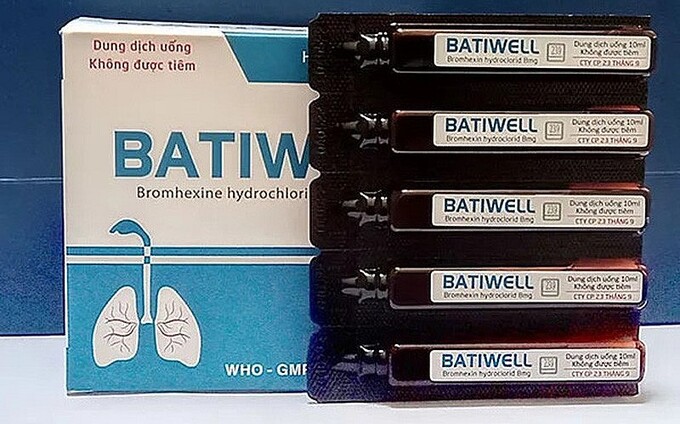
Lô thuốc dung dịch uống Batiwell (Bromhexin hydroclorid 0,8mg/ml) buộc phải thu hồi do không đạt tiêu chuẩn về chất lượng
>> Đường đi của thuốc giả đến Công ty Dược phẩm Đa Phúc
Được biết, mẫu thuốc nói trên do Trung tâm kiểm nghiệm Thuốc - Mỹ phẩm - Thực phẩm TP. Hà Nội lấy tại Công ty cổ phần dược phẩm Việt Nga có địa chỉ tại số 6A ngách 374 đường Âu Cơ, phường Nhật Tân (Tây Hồ, Hà Nội).
Kết quả kiểm nghiệm cho thấy, mẫu thuốc này không đạt tiêu chuẩn chất lượng về chỉ tiêu; độ đồng đều thể tích và độ đồng đều hàm lượng (vi phạm mức độ 2).
Vì vậy, Cục Quản lý Dược (Bộ Y tế) ra thông báo buộc phải thu hồi toàn quốc đối với lô thuốc này.
Công văn của Cục Quản lý Dược nêu rõ: Trong thời hạn 02 ngày kể từ ngày ký Công văn này, gửi thông báo tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc về việc thu hồi lô thuốc Dung dịch uống Batiwell (Bromhexin hydroclorid 0,8mg/ml) phải tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng.
Đồng thời, yêu cầu gửi báo cáo thu hồi lô thuốc về Cục Quản lý Dược trong vòng 18 ngày kể từ ngày ký Công văn.
Yêu cầu Sở Y tế TP. Hà Nội và TP. Hồ Chí Minh kiểm tra và giám sát Công ty 23 tháng 9 thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.
Cục Quản lý Dược cũng đề nghị sở y tế các địa phương, y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên.